PRACTICA XIII
REACCION DE KNOEVENAGEL
I. OBJETIVO
Obtener un ácido carboxílico a,b-insaturado mediante una reacción de condensación.
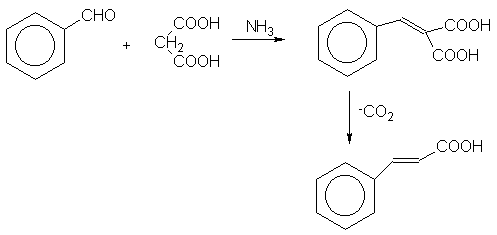
II. REACCION

III. MATERIAL
|
1 |
|
1 |
|
1 |
|
2 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 |
|
1 1 1 |
|
1 1 1 |
IV
. SUSTANCIAS
|
2.5 g |
|
6 ml |
|
10 ml |
|
2.5 ml |
V. INFORMACION
Los compuestos con metilenos activos producen reacciones de condensación con aldehidos y cetonas que se conocen como condensaciones de Knoevenagel. Estas condensaciones son catalizadas por bases muy débiles. La reacción es normalmente asociada con la producción de compuestos
a,b-insaturadosVI. PROCEDIMIENTO
Coloque en el matraz pera de 1 boca, 2.5 g de ácido malónico, 10 ml de solución de hidróxido de amonio en etanol al 8%. Agregue 2.5 ml de benzaldehído y ponga el refrigerante en posición de reflujo,(Nota 1). Caliente la mezcla mediante un baño de aire hasta la obtención de una solución clara. Elimine el etanol por destilacion(Nota 2) quite el sistema de destilación y continue el calentamiento a 130-150ºC hasta que cese la producción de dióxido de carbono. Enfrie la mezcla a temperatura ambiente, transfiera el residuo a un vaso de precipitado usando tres porciones de 25 ml de agua caliente( Nota 3) filtre en caliente y acidule el filtrado con HCl 1:1 hasta pH 2. Enfríe en baño de hielo, agite fuertemente para que cristalice el ácido (Nota 4). Filtre, lavar con agua helada y recristalizar de agua caliente (Nota5). Pese, calcular rendimiento y determine punto de fusión.
NOTAS
1) Aproximadamente por 10 min.
2) Debe de destilar unos 8.5 ml de etanol
3) Si no se disuelve completamente calentar con flama pequeña
4) Si al enfriar no cristaliza, debe agregarse mayor cantidad de HCl.
5)Para la recristalización se requiere un volumen considerable de agua.
VII. ANTECEDENTES
a) Diferentes tipos de bases utilizadas en estas reacciones de condensación.
b) Otras reacciones de condensación de aldehídos aromáticos.
c) Ventajas y desventajas del uso de la piridina y la piperidina.
d) Propiedades físicas químicas y toxicidad de reactivos y productos.
VIII. CUESTIONARIO
1) Explique a qué se debe que se efectúen este tipo de condensaciones.
2) ¿Porqué se usa el hidróxido de amonio?
3) ¿Para qué debe agregar ácido clorhídrico hasta pH ácido?
4) Asigne las bandas principales a los grupos funcionales presentes en los espectros de I.R. de
Espectros de I.R.
b)Acido malónico
IX. BIBLIOGRAFIA
1) R.J. Cremlyn y R.H. Still.
Named and Miscellaneous Reactions in Practical Organic Chemistry
John Wiley and Sons, Inc., New York (1967).
pag. 86-87.
2) J.A. Moore y D.L. Dalrymple
Experimental Methods in Organic Chemistry
2a. Ed.
W.B. Saunders Co.
Philadelphia, London, Toronto (1976).
3) R.T. Morrison y R.N. Boyd
Organic Chemistry
2d. Ed.
Fondo Educativo Interamericano S.A.
México(1985).