|
TÉCNICAS DE EXTRACCION CON DISOLVENTES ORGÁNICOS Y
DISOLVENTES ACTIVOS |
UI. OBJETIVOS
a) Conocer
la técnica de extracción como método de separación y
purificación de sustancias integrantes de una mezcla.
b) Elegir
los disolventes adecuados para un proceso de extracción.
c) Realizar
diferentes tipos de extracción: con disolventes orgánicos
(simple y
múltiple) y con disolventes activos (ácido, base, neutro),
aplicándolos a problemas específicos.
UII. MATERIAL
|
Matraz
redondo fondo plano 125 ml |
1 |
|
Agitador
de vidrio |
1 |
|
Refrigerante
p/agua c/mangueras |
1 |
|
Büchner
con alargadera |
1 |
|
T de
destilación |
1 |
|
Kitasato
de 250 ml * c/manguera |
1 |
|
Colector |
1 |
|
Embudo de
vidrio |
1 |
|
Emb. separación
Quickfit c/tapón |
1 |
|
Tubos
de ensayo 16 x 150 mm. |
9 |
|
Matraz
Erlenmeyer de 50 ml * |
2 |
|
Vidrio de
reloj |
1 |
|
Matraz
Erlenmeyer de 125 ml * |
2 |
|
Espátula |
1 |
|
Vaso de
pp. de 150 ml * |
2 |
|
Recipiente
eléctrico para B.M. |
1 |
|
Vaso de
pp. de 250
ml * |
2 |
|
Recipiente de
peltre |
1 |
|
Pipeta de
10 ml * |
1 |
|
Pinza
de tres dedos con nuez |
2 |
|
Probeta de
25 ml * |
1 |
|
Gradilla |
1 |
|
|
|
|
|
|
|
*
graduado |
|
|
|
|
UIII. SUSTANCIAS
|
Solución
yodoyodurada |
Sol.
de hidróxido de sodio al 10% |
|
Cloruro de metileno |
Sol.
de Hidróxido de sodio al 40% |
|
Eter etílico |
Sol.
de ácido clorhídrico al 10% |
|
Acetona |
Sol.
de ácido clorhídrico al 40% |
|
Naftaleno |
Sulfato
de sodio anhidro |
|
Acido benzóico |
Cloruro
de sodio Q.P. |
|
p-Toluidina |
|
UIV. INFORMACION
a) Los disolventes orgánicos utilizados en
extracción deben tener
baja
solubilidad en agua, alta capacidad de solvatación
hacia la
sustancia que se va a extraer y bajo punto de
ebullición
para facilitar su eliminación posterior.
b) El
coeficiente de reparto o distribución de un soluto, ante su
líquido de
disolución y su líquido extrayente es constante y
depende de la
naturaleza de dicho soluto, así como de la
naturaleza de
ambos disolventes y de la temperatura de trabajo.
c) La
extracción selectiva se emplea para separar mezclas de
compuestos
orgánicos, en función de la acidez, de la basicidad
o de la
neutralidad de éstos.
d) Los compuestos iónicos son más
solubles en agua que los
compuestos
covalentes y éstos, son más solubles en
disolventes
orgánicos que aquéllos.
e)
Se realizarán 2 técnicas diferentes:
·
Extracción con disolventes orgánicos.
·
Extracción con disolventes activos.
UV. EXTRACCIÓN CON DISOLVENTES ORGÁNICOS.
Problema. Se le proporcionará una
muestra de 30 ml de solución
yodoyodurada a la
que se le va a extraer el yodo.
Si se tiene un determinado volumen de
disolvente, ¿cuál de los
siguientes tipos
de extracción conducirá a un mayor rendimiento
de yodo extraído?
a) Utilizar
todo el disolvente en una sola operación de
extracción. UExtracción
simple.U
b) Dividirlo
en varias porciones iguales para hacer extracciones
sucesivas. UExtracción
múltiple.U
Con base en la información de la tabla
siguiente, elija el
disolvente
adecuado para extraer el yodo.
|
Disolvente |
Densidad g/ml |
Punto
de ebullición |
Solubilidad
en g/100 ml HB2B0
|
|
Eter dietílico |
0.7135 |
34.6°C |
7.5P
20P(Nota
1) |
|
Cloruro
de metileno |
1.325 |
39°C |
2.0 |
|
Acetona |
0.792 |
56.5°C |
Total |
¿Cuáles
de estos disolventes, al mezclarse con agua, formarán dos fases
![]() inmiscibles?
inmiscibles?
![]()
![]()
![]()
![]()
![]()
![]()
Tome
un volumen de 30 ml del disolvente elegido y divídalo en dos
porciones de 15 ml cada una.
Con
toda la información anterior, describa ahora la manera de hacer las extracciones.
![]() Extracción
simple:
Extracción
simple:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Extracción
múltiple:
Extracción
múltiple:
![]()
![]()
![]()
![]()
UPROCEDIMIENTOU
Utilice el embudo de separación para
hacer las extracciones (Nota 2).
Utilice 15 ml de solución yodoyodurada para
cada tipo de
extracción.
Sujete el embudo de separación a un soporte,
por medio de las
pinzas de tres
dedos. Cerciórese de que la llave esté cerrada,
agregue la solución
yodoyodurada y luego el disolvente extraente.
Coloque el tapón al embudo y agite
moderadamente. Disminuya la
presión interna del
mismo después de cada agitación.
Coloque el embudo en su posición normal, Uquite
el tapónU
y deje
reposar hasta que
haya separación de las fases.
Reciba las fases orgánicas y acuosa por separado en matraces
Erlenmeyer de 25 ml.
Después de realizar los dos tipos de
extracción, compare la
intensidad de la
coloración de las fases orgánica y acuosa
obtenidas en cada
caso. Recuerde que a mayor intensidad del color,
mayor concentración
del soluto disuelto y viceversa.
Anote sus resultados indicando cuál de los
dos procedimientos
![]()
![]()
![]() permite extraer
mayor cantidad de yodo.
permite extraer
mayor cantidad de yodo.
![]()
![]()
VI
UEXTRACCION CON
DISOLVENTES ACTIVOSU
Ó UEXTRACCION U
USELECTIVAU. ( Ácido, base, neutro).
Problema.- Se le
proporcionará tres compuestos orgánicos
diferentes: uno ácido, uno básico y uno neutro.
En tres tubos de ensayo coloque una pequeña
cantidad de cada uno
de ellos y haga
pruebas de solubilidad con disolventes
activos:
NaOH 10% y HCl 10%. Anote los resultados en
el siguiente cuadro.
|
Compuesto |
Disolvente
orgánico |
Sol.
acuosa NaOH 10% |
Sol.
acuosa HCl 10% |
|
Acido |
|
|
|
|
Base |
|
|
|
|
Neutro |
|
|
|
Con base en estos resultados y el inciso
"d" de la información
complete las
siguientes reacciones:
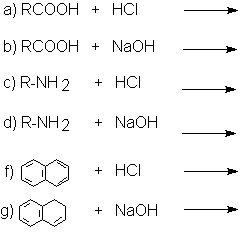
Conteste también las siguientes preguntas:
De los compuestos que fueron solubles en
HCl 10%.
a) ¿Cómo
los volvería a insolubilizar?
b) ¿Qué
haría para recuperarlos ya como sólidos?
De los compuestos que fueron solubles en NaOH 10%,
a) ¿Cómo
los volvería a insolubilizar?
b) ¿Qué
haría para recuperarlos ya como sólidos?
Si se tuviese un sistema de dos fases
inmiscibles, una orgánica y
una acuosa con pH
ácido, deduzca qué productos de las reacciones
anteriores serán
más solubles en la fase acuosa.
Para el mismo sistema de fases, donde la
fase acuosa tenga pH
básico, qué
productos de las reacciones anteriores serán solubles
en la fase acuosa.
Con los datos anteriores y las relaciones
de las fases
involucradas,
diseñe un diagrama de separación de compuestos:
ácido, básico y
neutro.
Mezcla
R-COOH R-NHB2 B B Naftaleno
Disolver en: 15
ml de UEter
etílicoU
![]()
Agregar 15 ml de NaOH al 10 %

fase orgánica fase acuosa
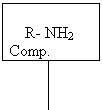
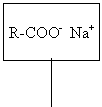
Agregar 15 ml de HCl al 10%
Agregar HCl conc.
![]()
![]()
![]()
R-COOH
fase
orgánica fase
acuosa
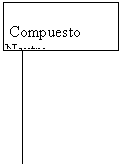
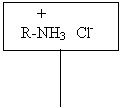
Secar con Sulfato Agregar NaOH al 40 %
de Sodio Anh.
R - NHB2B
Destilar éter
NAFTALENO
Solicite ahora 0.6 g
de mezcla problema y sepárela conforme
al diagrama, haciendo
extracciones para los compuestos que forman
dicha mezcla.
NOTAS
1) El
valor 7.5 P20P significa que 7.5g de éter son solubles en
100 ml de agua a una temperatura de
20°C.
2) La
manipulación correcta del embudo para las extracciones
deberá ser
indicada por el profesor. Revise que la llave esté
bien lubricada.
UVII. CONCLUSIONESU.
a) Con base en los resultados
experimentales. ¿cuál es la mejor
técnica de
extracción: la simple o la múltiple?
b) ¿Qué
es un disolvente activo? cite cinco ejemplos.
c) ¿En
qué casos debe utilizarse la extracción selectiva?
d) ¿En
qué casos debe utilizarse la extracción múltiple?
e) ¿Por qué el compuesto neutro debe obtenerse por destilación
del
disolvente en el que se encuentra y no por cristalización
en dicho
disolvente?
UVIII. ANTECEDENTES.U
a) Fenómeno de reparto o de distribución.
Coeficiente de reparto
o de
distribución.
b)
Métodos de extracción con disolventes orgánicos. Características
físicas y
químicas de los disolventes empleados.
c)
Disolventes activos empleados para extracción. Ácidos y bases
más
empleados. Sus características físicas y químicas.
d)
Diseño de diagramas de separación de mezclas: ácido-base-
neutro.
e) Agentes desecantes.
UIX. BIBLIOGRAFIA
a)
Experimental Methods in Organic Chemistry
Second
Edition
W.B.
Saunders Co.
b)
Introduction to Organic Laboratory Techniques
W.B.
Saunders Co.
c) Brewster R.Q., Vander Werf
Curso Práctico de Química Orgánica
Editorial Alhambra S.A.
Madrid, 1970.