DESTILACIÓN A
PRESIÓN REDUCIDA |
UI. OBJETIVOSU
a) Efectuar una destilación a presión
reducida para conocer sus
características
y los factores que intervienen en ella.
b) Aplicar
la técnica de destilación a presión reducida en la
purificación y
separación de líquidos de baja presión de vapor.
c) Conocer
y utilizar los nomogramas para estimar
presiones con
base en las
temperaturas en una destilación a presión reducida.
UII. MATERIALU
(Equipo para dos alumnos)
|
Matraz
redondo fondo plano 125 ml |
1 |
|
Probeta de
25 ml * |
2 |
|
Matraz de
bola de 25 ml |
2 |
|
Erlenmeyer de 50
ml * |
2 |
|
T de
destilación |
2 |
|
Kitasato de 250 ml * c/manguera |
1 |
|
T de
vacío |
1 |
|
Embudo de
vidrio |
1 |
|
Termómetro de
-10 a 400º |
1 |
|
Espátula |
1 |
|
Portatermómetro con rosca |
1 |
|
Barra
magnética |
1 |
|
Refrigerante p/agua
c/mangueras |
1 |
|
Parrilla con
agitación |
1 |
|
Vaso de
pp. de 250 ml * |
2 |
|
Pinza
de tres dedos con nuez |
4 |
|
|
|
|
Manguera para
vacío |
2 |
|
*
Graduados |
|
|
|
|
UIII. SUSTANCIASU
Propilenglicol y
anaranjado de metilo.
UIV. INFORMACION
a) El punto de ebullición de las
sustancias varía en relación
directa con la
presión.
b) La
relación entre la presión aplicada y la temperatura de
ebullición de
un líquido está determinada por su comportamiento
presión de
vapor-temperatura.
c) Algunas
sustancias de punto de ebullición alto se descomponen
al ser
sometidas a calentamiento excesivo.
d) Todas
las sustancias líquidas o mezclas de ellas, se purifican
o separan mejor
por algún método de destilación.
UV. PROCEDIMIENTO
Destile
30 ml de la muestra problema que se le proporcionará, utilizando un equipo de destilación
a presión reducida como el que está
montado como muestra en una mesa del laboratorio.
Para
colocar la muestra en el matraz, utilice un embudo de vidrio, para evitar que
se ensucie la boca del matraz. Todas las
juntas esmeriladas deben estar limpias y correctamente engrasadas.
Antes
de iniciar el calentamiento, confirme que el matraz esté correctamente asentado
en el centro de la parrilla y que el agitador magnético funciona bien. Fíjese que el termopozo
sostenga firmemente el termómetro (de lo contrario, se resbala al abrir el vacío
y puede romper el matraz). Abra
completamente la llave del vacío (fíjese antes dónde queda la máxima apertura).
Inicie
la agitación y enseguida el calentamiento.
Separe la cabeza y el cuerpo, siguiendo las variaciones de la
temperatura. Deje unos 5 ml del problema
en el matraz, para evitar que se queme (cola).
En cuanto termine, apague la parrilla y retírela, para evitar que se
siga calentando el matraz.
Cierre
la llave del vacío y espere a que el equipo se enfríe un poco para desmontar el
aparato. Mida los volúmenes obtenidos en
cada fracción y finalmente, localice en el nomograma la presión a la que
destiló la fracción principal.
Anote sus resultados en la siguiente tabla:
|
Fracción
|
Temperatura
de destilación (°C) |
Volumen (ml) |
Presión
a la que destiló (mm Hg) |
|
1 (cabeza |
- - - - - - - - - - - - - - - - |
|
U -
- - - - - - - - - - - U |
|
2 (cuerpo) |
|
|
|
|
3 (cola) |
- - - - - - - - - - - - - - - - |
|
|
UGrupos
de los compuestos representados en los nomogramasU.
|
Grupo 1 Antraceno Antraquínona Butiletileno Fenantreno Monocloruro de azufre Sulfuro de carbono Tricloroetileno Grupo 2 Alcanfor Anhidrido ftálico Benzaldehido Benzofenona Benzonitrilo Dibencilcetona Dimetilsilano Eteres Fluoruro de hidrógeno Fosgeno Hidrocarburos Hidrocarburos halógenados Metiletilcetona Monóxido de carbono Nitrotoluidinas Nitrotoluenos Quinoleína Salicilato de metilo Sulfocianuro de carbono Sulfuros Grupo 3 Acetaldehído Acetona Acido fórmico Aminas Benzoato de metilo Cianuro de hidrógeno Cloroanilinas Cloruro de cianógeno Cloruro mercúrico Esteres Eter metílico Metiletileter Naftoles Nitrobenceno Nitrometano |
Oxido de etileno Tetranitrometano Grupo 4 Acetofenona Acido acético Cianógeno Cloruro de nitrosilo Cresoles Diacetato de glicol Dimetilamina Dióxido de azufre Etilamina Formiato de metilo Oxalato de dimetilo Grupo 5 Acido propiónico Alcohol bencílico Amoníaco Fenol Metilamina Grupo 6 Acido isobutírico Agua Anhídrido Acético Grupo 7 Acido benzoico Acido butírico Acido heptanoico Acido isocaproico Acido valérico Alcohol metílico Etilenglicol Grupo 8 Alcohol p-amílico Alcohol etílico Alcohol isoámilico Alcohol isobutílico Alcohol n-propílico Cloruro mercuroso |
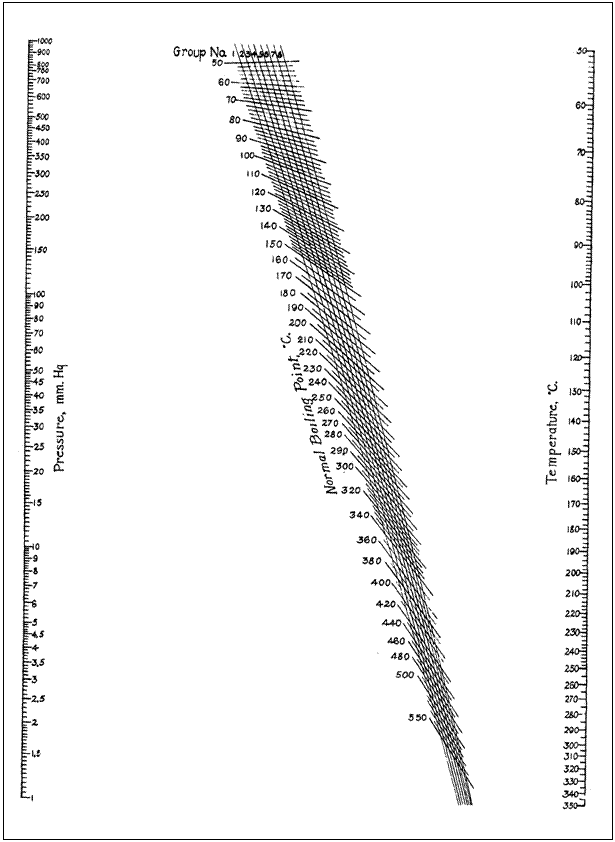 NOMOGRAMA de presión de
vapor-temperatura para líquidos de alto punto de ebullición.
NOMOGRAMA de presión de
vapor-temperatura para líquidos de alto punto de ebullición.
UVI. ANTECEDENTES.
a) Destilación a presión reducida.
Relación entre presión y puntos
de ebullición.
b) Aplicaciones
de la destilación a presión reducida.
c) Los
monogramas y su interpretación.
UVII. CUESTIONARIO
a) ¿Cuál es la relación que existe entre
la presión aplicada y la
temperatura
de ebullición de un líquido?.
b) Explique
la función del capilar en la destilación a presión
reducida.
c) Cite
dos formas de conocer la presión a la
que destila una
sustancia.
Explique.
d) Con
base en los resultados experimentales, explique sí este
método de
destilación es adecuado para purificar líquidos
y separarlos.
e) ¿En
que casos considera que la destilación a presión reducida
es el método
adecuado para purificar líquidos?.
f) ¿Como
elimina desechos de propilenglicol, etilénglicol y
dietilénglicol?.
UVII. BIBLIOGRAFIAU
·
Brewster R.Q., Vanderwerf, C.A.y McEwen, W. E. UCurso de Química Orgánica ExperimentalU,
·
Domínguez, X. A
y Domínguez .X. A., UQuímica
Orgánica ExperimentalU. Limusa,
México, 1990.
·
Fessenden R.J. and Fessenden J.S. UOrganic Laboratory TechniquesU. Brooks/Cole , USA., 1993.
·
·
·
Roberts R.M., Gilbert J.C., Rodewald
L.B. and Wingrove A.S. UAn Introduction
to Modern Experimental Organic Chemistry.U Holt,
Rinehart & Winston, USA., 1969U.
·
Vogel A.I. U Practical Organic ChemistryU, 5PaP ed.. Longman Scientific
& Technical,
·
NOMOGRAMAS: Lippincott S.B. and Lyman M.MU.“Vapor Pressure-Temperature NomographsU”. Industrial & Engineering Chemistry, U38U, 320 (1946).