|
DETERMINACIÓN DE
PUNTO DE FUSIÓN |
I.
OBJETIVOS
·
Saber usar el punto de fusión como criterio de
pureza de las sustancias orgánicas sólidas.
·
Aprender a determinar el punto de fusión en
diferentes tipos de aparatos.
·
Aprender a aplicar el punto de fusión mixto como
criterio de identidad de los compuestos orgánicos.
II.
MATERIAL
|
Agitador de vidrio |
1 |
|
Espátula |
1 |
|
Vidrio de reloj |
1 |
|
Mechero con manguera |
1 |
|
Termómetro de -10 a 400ºC |
1 |
|
Pinza de tres dedos con nuez |
1 |
|
Vaso de pp de 100 ml
* |
1 |
|
Tubo de vidrio de 30 cm |
1 |
|
Tubos capilares |
3 |
|
Tubo de Thiele
c/tapón de |
1 |
|
|
|
|
corcho |
|
|
*
Graduado |
|
|
|
|
MATERIAL ADICIONAL.-
En equipo de 3 alumnos.
(Se les proporcionará con su credencial):
|
Aparato Fisher-Johns para punto de fusión. |
1 |
|
Cubreobjetos redondos |
8 |
III.
SUSTANCIAS
|
Se utilizarán sustancias sólidas cuyos puntos de fusión estén comprendidos dentro de la escala del termómetro. |
|
Aceite de Nujol |
|
Acetona-metanol (1:1) (para lavar los cubreobjetos) |
IV. INFORMACIÓN
a) La
pureza e identidad de una sustancia orgánica puede quedar establecida cuando
sus constantes físicas (punto de fusión,
punto de ebullición, color, densidad, índice de refracción, rotación óptica,
etc.), corresponden con las
indicadas
en la literatura para dicha sustancia.
Por ser de fácil determinación y por ser los más citados, tanto el Upunto
de fusiónU como el de ebullición son operaciones de
rutina en los laboratorios de Química Orgánica.
b) El
Upunto
de fusiónU de un compuesto
sólido cristalino es la temperatura a la que cambia de sólido a líquido y
siempre es informado dando UdosU
temperaturas: la primera es cuando
aparece la primera gotita de líquido y la segunda es cuando la masa cristalina
termina de fundir y aparece de pronto como un líquido claro. Por ejem., el pf del ácido benzoico se informa como:
Pf = 121 – 122º
c) Cuando
un compuesto orgánico esU
puroU, el intervalo entre los dos valores es
muy pequeño, de 1 ó 2 grados; sin embargo, si el compuesto esU impuroU,
muestra una temperatura más baja y un intervalo más amplio.
d) Aprovechando
esta característica, se emplea el Upunto
de fusión mixtoU
(punto de
fusión de una mezcla) para determinar la identidad de un
compuesto:
·
Si se mezclan dos muestras diferentes de Ula
misma sustanciaU, el
resultado sigue siendo la misma sustancia pura.
·
Si se mezclan dos muestras de sustancias UdiferentesU,
éstas se impurifican entre sí, por lo cual la mezcla fundirá a una temperatura
más baja y el intervalo de fusión será más amplio.
e) Existen
actualmente muchos tipos de aparatos para determinar el punto de fusión. En este laboratorio, usaremos dos: el Utubo
de ThieleU (muestra en capilar) y el Uaparato
deU UFisher-JohnsU (muestra en cubre-objetos).
V. PROCEDIMIENTO
A.- APARATO DE FISHER-JOHNS
El aparato de Fisher-Johns consta de una platina
calentada mediante una resistencia eléctrica, en la que se coloca la muestra
entre UdosU
cubre-objetos redondos (unos cuantos
cristales en el centro del cubre-objetos).
La velocidad de calentamiento se controla con un reóstato integrado al
aparato y la temperatura de fusión de la sustancia se lee en el termómetro
adosado a dicha platina.
1).- Calibración del
termómetro del aparato:
Se le proporcionará tres
sustancias estándar de punto de fusión
conocido a las que deberá determinarles el punto de fusión en el aparato
de Fisher-Johns. Para mayor exactitud de las determinaciones y con base en el
punto de fusión conocido de cada estándar, calcule la velocidad óptima de calentamiento que debe utilizar en el reóstato
del Fisher-Johns, a través de la siguiente fórmula:
Velocidad
de calentamiento = (P.f. conocido x 0.8) / 3
= UPf conocidoU
4
Anote sus puntos de fusión en la siguiente tabla:
|
Sustancias |
Pf teórico |
Pf experimental |
|
|
|
|
|
|
|
|
|
|
|
|
Trace luego una Ugráfica
de calibraciónU
del termómetro de su aparato Fisher-Johns
en papel milimétrico, colocando en las abscisas
los puntos de fusión teóricos conocidos y en las ordenadas los puntos de fusión obtenidos
experimentalmente.
Esta gráfica se utiliza para corregir puntos de fusión
experimentales, localizando primero en las ordenadas
el valor experimental y extrapolando hacia las abscisas para encontrar el punto de fusión corregido.
2).- Problema y punto de fusión mixto
Puede usarse el Experimento No. 1 (tres muestras
diferentes), o bien, si se desea, se puede usar como UalternativaU
el Experimento No. 2 (el problema de su
cristalización), a elección del profesor.
UExperimento No. 1
a).- U Punto de fusión de las
sustancias problema
Se le
proporcionará UtresU
muestras sólidas, de las cuales UdosU
de ellas son iguales. Para cada muestra o sustancia, haga dos
determinaciones. (Recuerde que sólo se
colocan unos cuantos cristales de la muestra en el centro de un cubre-objetos y
se cubre con el otro).
La Uprimera
determinaciónU
permite conocer aproximadamente el punto de fusión, al que llamaremos pf aproximado ó pf
estimado. (Coloque en 50
el botón del reóstato, que es una
velocidad intermedia de calentamiento).
La Usegunda
determinaciónU
permitirá conocer el pf más exactamente, si se utiliza la velocidad
óptima de calentamiento, que para este caso está dada por la fórmula:
Velocidad de calentamiento = UPf
estimadoU
4
Corrija
(usando su gráfica) los pf obtenidos en esta segunda
determinación y anótelos en el cuadro siguiente. (No
olvide anotar los dos valores, de inicio y de término).
|
Sustancia: |
A |
B |
C |
|
Pf
corregido (ºC) |
|
|
|
Seleccione ahora las sustancias que sospecha son iguales y
por medio de la técnica del p.f. mixto, podrá
concluir cuáles son las dos sustancias iguales.
b).-U Punto de fusión mixto.U
Con las sustancias
que pueden ser iguales, prepare una pequeña mezcla en proporción 1:1,
homogenícela y determínele el p.f. ante las
sustancias individuales, colocando las muestras en un mismo cubreobjetos, como se indica en la Fig.
1. Anote Ulos
tresU
puntos de fusión. Es muy importante que
anote los dos valores del intervalo en cada
pf, ya
que eso también nos dará información.
![]()
![]()
 Sustancia 1
Sustancia 2
Sustancia 1
Sustancia 2
Pf =
![]()
![]() Pf =
Pf =
![]()
![]()
Mezcla
Pf =
(Figura 1)
|
UCONCLUSIÓNU: Diga
si las sustancias son iguales o diferentes.
Explique por qué. |
|
|
|
|
UExperimento No. 2
(Alternativo)U
a).-U Punto de fusión de la sustancia problema
Determine
el pf de la sustancia problema que usó para
realizar su UcristalizaciónU,
ahora en el aparato de Fisher-Johns, y compárelo con los de la Lista de sustancias posibles. Es probable que encuentre varios pf parecidos.
(No olvide controlar la velocidad de calentamiento).
Anote
aquí su pf (anote los dos valores, el de inicio y el de término,
para conocer el intervalo)
|
Pf Sustancia problema |
Sustancias
posibles: |
Pf |
|
|
|
|
|
Pf= |
|
|
b).-U Punto de fusión mixto.U
Para
confirmar ó rechazar la identidad de su sustancia problema, lleve a cabo el punto de fusión mixto, para lo cual
coloque unos cristalitos de la Usustancia
conocidaU a la
izquierda del cubre-objetos (observe la Fig. 2), unos cristalitos de su Usustancia
problemaU a la
derecha y un poco de la UmezclaU
de ambos, abajo. (Para hacer la mezcla,
puede poner unos cristalitos de cada uno en un vidrio de reloj y molerlos con
el extremo de un agitador).
Realice
todos los Pf mixtos que necesite, hasta identificar
su sustancia problema, dibujando en su cuaderno los esquemas y anotando los UtresU
puntos de fusión en cada uno, con su intervalo, ya que eso nos proporciona
información.
![]()
![]()
 Sustancia conocida
Sustancia UproblemaU
Sustancia conocida
Sustancia UproblemaU
![]()
![]() Pf =
Pf =
Pf =
Pf =
![]()
![]()
Mezcla
Pf =
(Figura 2)
B.- MÉTODO DEL TUBO DE THIELE
Para Ucerrar
los capilaresU, caliente el tubo de vidrio con un mechero y
estírelo cuando se ablande; luego funda el extremo delgado para cerrarlo.
Para Ullenar
el capilarU, pulverice
la sustancia en un vidrio de reloj con la punta de un agitador y aplique el
extremo abierto del capilar sobre la sustancia.
Enseguida, tome un tubo de vidrio de unos 30 cm. de largo, apoye un extremo en la mesa
y deje caer por arriba el capilar (el extremo cerrado hacia abajo), hasta que
la sustancia quede en el fondo del capilar con una altura de unos U2 mm.U Ahora
cierre con cuidado el capilar por su otro extremo.
El capilar ya preparado Use
une al termómetroU mediante
una rondana de hule (la cual nunca debe
tocar el aceite). Observe que la
sustancia en el capilar quede pegada al bulbo del termómetro. (Fig. 3).
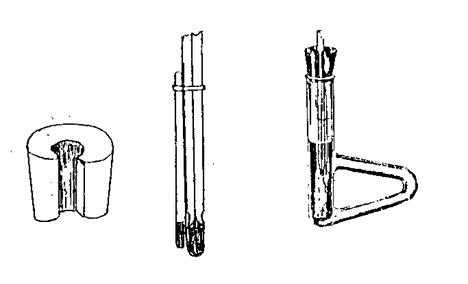
(Figura 3)
Llene
el tubo de Thiele con aceite mineral (Nujol) hasta cubrir la entrada superior del brazo lateral
(observe la Fig. 3) y sosténgalo en un soporte con unas pinzas. Coloque el termómetro con el capilar en el
corcho horadado, cuidando que el bulbo del termómetro (y la muestra) queden al
nivel del brazo superior del tubo lateral, sin que el aceite toque la rondana
de hule (porque se afloja y se cae el capilar). Comience a calentar suavemente el brazo
lateral del tubo de Thiele con un mechero.
UPrimera
determinaciónU.- Para
conocer aproximadamente a qué temperatura funde su muestra, regule el
calentamiento del tubo de Thiele de tal manera que la
temperatura aumente a una velocidad de U20º por minutoU.
USegunda
determinaciónU.- Prepare
otro capilar con la muestra pulverizada.
Repita el procedimiento y una vez que falten unos 30º para llegar a la
temperatura de fusión, disminuya la velocidad de calentamiento a U2º porU
UminutoU.
Anote
sus datos en el cuadro siguiente:
(Anote las dos
temperaturas, de inicio y de término, en cada pf.)
|
1ª determinación |
Pf = |
|
2ª determinación |
Pf = |
VI. CONCLUSIONES
a)
¿A qué se le llama punto de fusión?
b)
¿Por qué deben anotarse las dos
temperaturas (inicio y término) de un punto de fusión?
c)
¿Por qué debe calibrarse el termómetro
del aparato de Fisher-Johns?
d)
¿Qué utilidad tiene la gráfica de
calibración?
e)
Explique si la grafica de calibración
de UunU
aparato Fisher-Johns puede utilizarse para trabajar en otros aparatos similares
¿si?, ¿no?, ¿por qué?
f)
¿Por qué es necesario controlar la velocidad
de calentamiento para determinar un pf?
g)
Dibuje el esquema de su punto de fusión
mixto, con sus puntos de fusión con intervalo.
h)
Explique a qué conclusión llegó (si sus
sustancias son iguales o diferentes) y explique por qué.
i)
Si realizó el Experimento No. 2, dibuje
los esquemas de los pf mixtos que haya realizado, con
sus valores de pf
cada uno (con sus intervalos) y
explique cómo logró identificar
su muestra problema.
VII. ANTECEDENTES.
a)
Punto de fusión como constante física.
b)
Factores que determinan la fusión de un
sólido.
c)
Métodos, aparatos y equipos para
determinar punto de fusión: Tubo de Thiele, UFisher-JohnsU,
Kofler, Büchi, etc.
d)
Puntos de fusión de sustancias puras e
impuras. Mezclas eutécticas.
e)
Punto de fusión mixto.
VIII.
BIBLIOGRAFÍA
·
·
Brewster R.Q., Vanderwerf, C.A.y McEwen, W. E. UCurso de Química Orgánica ExperimentalU,
·
·
Fessenden R.J. and Fessenden J.S. UOrganic Laboratory TechniquesU. Brooks/Cole , USA., 1993.
·
·
PastoP1P D.J., Johnson
C.R. and Miller M.J. UExperiments And
Techniques in Organic ChemistryU. Prentice Hall,
·
PastoP2P D.J., Johnson
C.R. UOrganic Structure DeterminationU. Prentice
Hall,
·
·
Roberts R.M., Gilbert J.C., Rodewald
L.B. and Wingrove A.S. UAn Introduction
to Modern Experimental Organic Chemistry.U Holt,
Rinehart & Winston, USA., 1969U.
·
Shriner, R. L., Fuson, R. C., Curtin, D.Y.
UIdentificación Sistemática
de Compuestos OrgánicosU. Limusa, México,
1995.
·
Vogel A.I. U Practical Organic Chemistry including Qualitative
Organic AnalysisU, 4PaP ed..