|
PRUEBAS DE
SOLUBILIDAD EN DISOLVENTES
ORGÁNICOS Y CRISTALIZACIÓN SIMPLE
Y CON CARBÓN
ACTIVADO |
UI. OBJETIVOS.
- Realizar pruebas de solubilidad para encontrar
un disolvente ideal para efectuar una cristalización.
- Purificar un compuesto orgánico sólido por el
método de cristalización.
- Utilizar un adsorbente para eliminar impurezas
coloridas.
UII MATERIAL
|
Agitador
de vidrio |
1 |
|
Büchner con
alargadera |
1 |
|
Matraz Erlenmeyer
de 50 ml.
* |
2 |
|
Kitasato
de 250 ml. c/manguera |
1 |
|
Matraz Erlenmeyer
de 125 ml.
* |
2 |
|
Espátula |
1 |
|
Matraz Erlenmeyer
de 250 ml.
* |
1 |
|
Mechero con
manguera |
1 |
|
Vaso
de precipitados de 150 ml.
* |
2 |
|
Anillo de
hierro |
1 |
|
Vaso
de precipitados de 250 ml. |
1 |
|
Tela de
alambre con asbesto |
1 |
|
Tubos de
ensayo 16 x 150 mm. |
10 |
|
Pinza p/tubo
de ensayo |
1 |
|
Pipeta de
10 ml. * |
1 |
|
Pinza de
tres dedos c/nuez |
1 |
|
Probeta de
25 ml. * |
1 |
|
Gradilla |
1 |
|
Vidrio de
reloj |
1 |
|
Recipiente de
peltre |
1 |
|
Embudo de
vidrio |
1 |
|
Recipiente
eléctrico para B.M. |
1 |
|
|
|
|
|
|
|
* Graduados |
|
|
|
|
UIII SUSTANCIAS
|
Sustancia problema |
1 g |
Etanol |
20 ml |
|
Hexano |
20 ml |
Metanol |
20 ml |
|
Cloruro
de metileno |
20 ml |
Agua destilada |
100
ml |
|
Acetato
de etilo |
20 ml |
Carbón
activado |
0.5
g |
|
Acetona |
20 ml |
Celita |
0.5 g |
II.
INFORMACIÓN.
·
La
técnica más empleada para la purificación de compuestos sólidos es la cristalización, que consiste en
disolver el soluto en la mínima cantidad de un disolvente caliente apropiado,
dejar enfriar la solución para que se formen cristales y separarlos por
filtración.
·
El
disolvente ideal para recristalizar
una sustancia es aquél en el que Uel solutoU
es poco soluble en frío y muy soluble en caliente. El disolvente ideal, no deberá solubilizar
ninguna impureza, o deberá solubilizarlas tanto que al enfriar la solución
queden disueltas en las aguas madres.
·
Decimos
que un sólido UesU
UsolubleU
en un disolvente cuando al mezclarlos forman una fase homogénea (en una relación de 0.1 g de soluto en máximo 3 ml de disolvente). La solubilidad de un sólido en un disolvente
está relacionada con la estructura química de ambos y por lo tanto con sus
polaridades. En general podemos decir
que lo semejante disuelve a lo semejante.
·
Algunas
veces, se tienen como impurezas pequeñas cantidades de material colorido o
resinoso (de cadena larga o polimerizado), o bien,
productos de descomposición que imparten color a la sustancia. Para eliminar estas impurezas
coloridas. se emplea el Ucarbón activadoU. Éste se encuentra finamente pulverizado, con
lo cual presenta una gran superficie de contacto y puede adsorber compuestos
orgánicos de mayor polaridad, como son los compuestos coloridos y los polímeros.
·
Los pasos a
seguir en una
cristalización son:
a)
UDisoluciónU
del compuesto sólido en el disolvente ideal Ua ebullición.U
b)
UEliminaciónU
de las impurezas UcoloridasU (si las hay) por
ebullición con carbón activado.
c)
UEliminaciónU
de las impurezas UinsolublesU por Ufiltración en calienteU. (En el caso de haber usado carbón activado,
se puede usar un ayuda-filtro).
d)
UInducciónU
de la cristalización (formación de los cristales). Además de dejar enfriar a temperatura
ambiente y luego en baño de hielo-agua, también se puede inducir la
cristalización tallando las paredes del matraz con una varilla de vidrio,
sembrando cristales, etc.
e)
USeparaciónU
de los cristales de las aguas madres por Ufiltración al vacíoU.
f)
ULavadoU
de los cristales con Uun pocoU
del disolvente UfríoU.
g)
USecadoU
de los cristales.
·
Para
Ucalentar a ebulliciónU
los disolventes orgánicos, siempre se empleará un baño-maría o una parrilla de
calentamiento, debido a su inflamabilidad.
(Sólo en el caso de estar usando agua, podrá emplearse el mechero
bünsen, siempre y cuando no haya disolventes orgánicos cerca).
·
Para
UenfriarU,
es más eficiente un UbañoU
de Uhielo-aguaU,
que uno de hielo solo, ya que así aumenta el contacto del agua fría con el
matraz. (Pavia, 2ª. ed., pag. 611).
V. PROCEDIMIENTO.
A.- CRISTALIZACIÓN SIMPLE.
a).- Solubilidad en disolventes orgánicos.-
Coloque en un
tubo de ensayo 0.1 g de la muestra problema. Agregue 1 ml del disolvente a
probar, agite y observe. Si el sólido no
se ha disuelto, agregue otro ml y observe con cuidado (pueden quedar impurezas
insolubles). Si no se disuelve, repita
el procedimiento, hasta 3 ml máximo.
Si el sólido no
se ha disuelto, es Uinsoluble en fríoU;
si se ha disuelto, Ues soluble en frío.
Si la
sustancia fué insoluble en frío, caliente la muestra en baño-maría hasta
ebullición y con agitación constante, cuidando de mantener inalterado el
volumen de la solución. (Si el disolvente es agua, agregue cuerpos de
ebullición y caliente en mechero hasta ebullición). Observe si hay solubilización o no.
Si la sustancia no
se disolvió, es Uinsoluble en calienteU;
si lo hizo, es Usoluble enU
UcalienteU.
Si la
sustancia fué soluble en caliente. enfríela a
temperatura ambiente y luego en baño de hielo-agua. Observe si hay formación de cristales.
Anote sus
resultados en la siguiente tabla :
|
Disolventes: |
Hexano |
Cloruro
de metileno |
Acetato de etilo |
Acetona |
Etanol |
Metanol |
Agua |
|
Solubilidad en
frío: |
|
|
|
|
|
|
|
|
Solubilidad en caliente: |
|
|
|
|
|
|
|
|
Formación de cristales: |
|
|
|
|
|
|
|
b).- Cristalización simple.-
NOTA.-Antes de comenzar a
trabajar, lea completamente el procedimiento
y asegúrese de tener
a la mano todo lo necesario.
Pese
el resto que le haya sobrado y colóquelo en un matraz Erlenmeyer de tamaño
apropiado (siempre se usan matraces Erlenmeyer
para cristalizar). Agregue Upoco a pocoU el disolvente ideal, previamente
calentado (comience con 10 ml). Caliente la mezcla hasta ebullición,
agitando constantemente, y continúe agregando disolvente hasta disolución
completa. (Utilice cuerpos porosos para
controlar la ebullición).
Para
eliminar las impurezas insolubles, habrá que Ufiltrar en calienteU. Este paso debe hacerse rápidamente, para
evitar que el producto cristalice en el embudo.
Para
filtrar en caliente, doble el papel
filtro para filtración rápida (Fig,
1), precaliente un embudo de vidrio y el
matraz en el que recibirá el filtrado.
Monte el embudo sobre el matraz dejando un hueco entre ambos para que
“respire” (Fig. 2). Humedezca el papel
filtro con un poco del disolvente caliente
y Ufiltre en calienteU. Enjuague el matraz y el papel filtro con un
poco (3 a 5 ml) del disolvente caliente.
Deje enfriar el filtrado a
temperatura ambiente y luego en baño de hielo-agua para que se formen los
cristales Si esto no ocurre, entonces Use induceU la cristalización.
Para inducir la cristalización:
·
Talle
con una espátula o una varilla de vidrio las paredes del matraz (en la interfase solución-aire) y luego enfríe el matraz en un
baño de hielo-agua.
·
Si
no cristaliza, posiblemente se deba a que hay un exceso de disolvente; en tal caso, agregue cuerpos de ebullición y
concentre la solución, llevándola a ebullición para evaporar parte del
disolvente. Vuélvala a enfriar, tallando
las paredes con una espátula.
·
Algunas
veces, es necesario “sembrar” unos cristalitos de la sustancia pura, y
repetir el procedimiento de tallar y enfriar.
Una
vez formados los cristales, sepárelos de las aguas madres por Ufiltración al vacíoU. Para esto, fije el matraz Kitasato con unas
pinzas para evitar que se vuelque y conéctelo a la llave del vacío mediante su
manguera; al embudo Büchner se le coloca dentro un
círculo de papel filtro, cuidando que ajuste perfectamente y se conecta al
Kitasato mediante un adaptador de hule.
Se humedece el papel filtro con un poco del disolvente frío, se abre la llave del vacío suavemente,
sólo a que se fije el papel, y se vierte el contenido del matraz de
cristalización. (primero se inclina el matraz Erlenmeyer y
con la espátula se pasa la mayor parte de los cristales al fondo del mismo y
luego se comienza a verter, moviendo el matraz y jalando los cristales con la
espátula; hay que hacerlo con cierta rapidez, para que no se queden los
cristales en el Erlenmeyer). Para
terminar de bajar los cristales, se puede utilizar una UpequeñaU cantidad (máximo 5 ml) del
mismo disolvente UfríoU,
ayudándose con la espátula, o bien, usar las mismas aguas madres (del matraz
Kitasato), si están transparentes.
Para eliminar los restos de
aguas madres, los cristales se lavan,
agregando por encima, repartiéndola sobre toda la superficie, una pequeña
cantidad (≈ 5 ml) del mismo disolvente bien frío. (Si ya agregó más disolvente para bajar los
cristales, omita este paso).
Para secar los cristales, se deja que termine de filtrar
la mayor parte del disolvente y se oprime la masa de cristales con la
varilla. Una vez que deje de gotear, se
cierra la llave del vacío y se retira el embudo Büchner; el filtrado del Kitasato se pasa a un matraz Erlenmeyer y se
vuelve a colocar el Büchner, y esta vez se abre UtodaU la llave del vacío, para
permitir que los cristales se sequen. (Para saber si ya están UsecosU, se tocan los cristales
con Uel nudilloU
de los dedos índice o medio ). En el caso de que aún se sientan húmedos, una
forma rápida de secarlos es Ucambiar el papel filtroU. Para esto, se pasan los cristales con la
espátula a un cuadro de papel normal, limpio, y se pone un nuevo círculo de
papel filtro en el Büchner, se abre el vacío para fijar el papel filtro y se
vuelven a colocar los cristales, esparciéndolos con la espátula, y se dejan
secar.
Para obtener una segunda
cosecha de cristales, cuando
las aguas
madres contienen aún bastante
material, el filtrado se concentra por ebullición, eliminando así el disolvente
en exceso y volviendo a inducir la cristalización. Esta segunda cosecha generalmente es menos
pura que la primera, y no se deben mezclar, sino
guardar en una bolsa aparte; sin
embargo, sí se tiene en cuenta para calcular el rendimiento.
Finalmente, se calcula el rendimiento de la cristalización.
B.- CRISTALIZACION CON
CARBON ACTIVADO.
- Se
utiliza cuando existen impurezas coloridas o resinosas.
Pese su muestra y colóquela
en un matraz Erlenmeyer de tamaño apropiado.
Agregue poco a poco el disolvente elegido, previamente calentado
(comience con 10 ml). Caliente hasta ebullición,
agitando constantemente, y continúe agregando disolvente hasta disolución
completa (no olvide usar cuerpos porosos para controlar la
ebullición).
URetire el matrazU
de la fuente de calentamiento y agregue otros
5 ó 10 ml más de disolvente frío, deje enfriar un
poco (¡nunca se agrega el carbón con la
solución hirviendo o muy caliente!) y agregue una punta
de espátula de carbón activado (≈ 0.1
g), adicione cuerpos porosos y vuelva a hervir, teniendo cuidado de
agitar constantemente, ya que tiende a saltar demasiado. Deje hervir unos 3 min., teniendo cuidado de
mantener constante el volumen de disolvente, y Ufiltre en calienteU,
por filtración rápida, usando papel filtro de poro cerrado.
Si el filtrado aún muestra
coloración, se repite el procedimiento.
Algunas
veces, el filtrado queda con restos de carbón como polvo muy fino; en tal caso, se vuelve a calentar y
se filtra a través de papel filtro de poro cerrado, o bien, a través de una
capa de algún Uayuda-filtroU
(polvo inerte que se coloca como una capa sobre el papel filtro, se humedece
con el disolvente empleado, y luego se filtra la solución problema).
Una vez que el filtrado ha
quedado incoloro, se enfría y se induce
la cristalización. Los cristales formados se filtran al vacío,
se lavan si es necesario y se dejan secar.
Con el producto seco, se calcula el rendimiento.
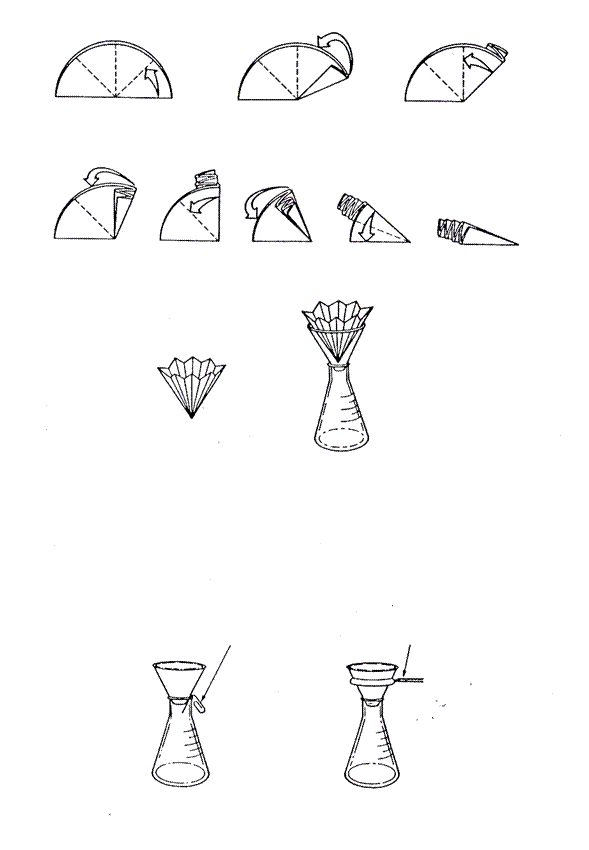
Fig. 1.- Doblado del papel filtro para filtración
rápida. Doble el papel filtro a la
mitad y luego sígalo doblando como un acordeón o un abanico. Se abre, se coloca sobre el embudo y se
humedece con el mismo disolvente
que se está empleando. Fig. 2.- Maneras para crear un
espacio entre el embudo y el matraz, para evitar que se
“ahogue” al estar filtrando. Anillo
de fierro Un
clip abierto o un
rollito de papel
VI.
ANTECEDENTES.
- Solubilidad.
a)
Explicación de solubilidad como
fenómeno físico.
b)
Relación entre solubilidad y estructura
molecular.
c)
Polaridad y solubilidad.
d)
Efecto de las fuerzas intermoleculares
en la solubilidad.
e)
Solvatación e hidratación.
f)
Disolventes próticos y apróticos.
- Pruebas de
solubilidad.
a)
En disolventes orgánicos.
b)
Interpretación de las pruebas de
solubilidad relacionadas con la estructura del compuesto.
c)
Importancia de las pruebas de
solubilidad en cristalización.
d)
Orden de polaridad de los disolventes. (Tabla).
e)
Propiedades físicas de los disolventes
orgánicos.
f)
Precauciones indispensables para el
manejo de los disolventes.
- Cristalización
a) Fundamentos de la
cristalización
b) Principales tipos
de cristalización
c) Secuencia para
realizar un recristalización simple
d) Disolventes más empleados
para recristalizar
e) Selección del
disolvente ideal
f) Métodos para inducir una cristalización
g) Diferencia entre
una cristalización y una precipitación
h) Secuencia para
realizar una cristalización con carbón activado
i) Tipos de
adsorbentes y fenómeno de adsorción.
j) Soluciones
saturadas y sobresaturadas.
- Técnicas
a)
Diversos tipos de filtración
b) Doblado de papel
filtro
c) Secado de
productos cristalizados
d) Evaporación del
disolvente
VII.
CUESTIONARIO
1.- Solubilidad en disolventes orgánicos.
a.
De acuerdo con las pruebas de
solubilidad, ¿cuál es el grado de polaridad de su compuesto?.
Fundamente su respuesta.
b.
¿Cuándo un disolvente es el ideal para
efectuar una recristalización? Explique.
En base a su respuesta, ¿cuál disolvente seleccionó para recristalizar su problema?.
c.
Un sólido que es soluble en determinado disolvente frío, ¿puede ser recristalizado
en dicho disolvente?, ¿por qué?
d.
Un sólido que es insoluble en un disolvente caliente, ¿puede recristalizarse de él?,
¿por qué?
2.- Cristalización.
a)
¿Qué cualidades debe tener el
disolvente que va a usar para llevar a cabo una recristalización?
b)
Al disolver su sólido ¿notó cambios?
¿cuáles?
c)
¿Para qué se agregan las piedras
porosas?
d)
¿Cómo escoge la fuente de calentamiento
que usará en la recristalización?
e)
¿Por qué se debe filtrar en caliente y
el embudo de vidrio, al igual que el matraz donde recibe el filtrado, deben
estar previamente calentados?
f)
Anote las diferencias que presenta el
producto antes y después de purificarlo.
g)
Explique para qué se agrega el carbón
activado.
h)
¿Por qué debe quitar la fuente de
calentamiento antes de agregarlo?
i)
¿Cómo era su problema antes y después
de recristalizarlo con carbón activado?
VIII. BIBLIOGRAFIA
a)
b)
Bates R.B., Schaefer J.P. UTénicas
de Investigación en Química OrgánicaU,
Prentice-Hall Internacional, Madrid, 1977.
c)
Brewster R.Q. y Vander Werf C.A. UCurso
Práctico de Química OrgánicaU, 3PaP.
ed..
d)
Domínguez X.A.
y Domínguez X.A. UQuímica Orgánica ExperimentalU.
Limusa, México, 1982.
e)
Fessenden R. J.
and Fessenden J. S. UTechniques and Experiments forU UOrganic ChemistryU. Willard Grant,
f)
Gatterman
L. ULaboratory
Methods of Organic ChemistryU.
MacMillan,
g)
h)
i)
Pasto D.J. y Johnson C.R. UDeterminación
de Estructuras OrgánicasU.
Reverté, Madrid, 1974.
j)
Shriner R.L., Fuson R.C. y Curtin D.Y. UIdentificación
Sistemática deU
UCompuestos
OrgánicosU. Limusa, México. 2001.
k)
Vogel A.I. UText Book Practical
Organic ChemistryU, 3PrdP. ed.. Longmans,