ANALISIS CUALITATIVO ELEMENTAL ORGANICO
UI. OBJETIVOSU
a) Conocer algunas pruebas sencillas de
laboratorio en las que
se basa el
análisis cualitativo elemental orgánico.
b) Identificar,
a través de reacciones específicas, los elementos
más comunes que constituyen a los compuestos orgánicos.
c) Adiestrarse
en el manejo de pequeñas cantidades de sustancias
que requiere
este tipo de trabajo analítico.
II. MATERIAL
|
Agitador de
vidrio |
1 |
|
Vidrio de
reloj |
1 |
|
Pipeta de 5 ml * |
1 |
|
Frascos “viales” |
3 |
|
Vaso de
pp. de 250 ml * |
2 |
|
Espátula |
1 |
|
Vaso de
pp. de 100 ml * |
1 |
|
Pinzas
para tubo de ensayo |
1 |
|
Tubos
de ensayo de 16 x 150 mm. |
9 |
|
Pinzas
de tres dedos con nuez |
1 |
|
Tubo de
desprendimiento |
1 |
|
Mechero con
manguera |
1 |
|
Embudo de
vidrio |
1 |
|
Gradilla |
1 |
|
|
|
|
|
|
|
* graduado |
|
|
|
|
UIII. SUSTANCIAS
|
Sodio
metálico |
Acido
sulfúrico conc. |
|
Etanol |
Acido
clorhídrico conc. |
|
Oxido
cúprico (CuO) |
Acetato
de plomo |
|
Nitroprusiato
de sodio |
Hipoclorito de sodio, sol. comercial |
|
Nitrato
de plata |
Tetracloruro
de carbono |
|
Hidróxido
de bario |
Acido
nítrico conc. |
|
Sulfato
ferroso |
Hidróxido
de amonio |
|
Acido
acético |
Dióxido
de plomo |
Para
las muestras problema, utilizar diversas sustancias que
contengan C, H, 0, N, S, Cl, Br, I.
UIV. INFORMACIONU
a) Los elementos más comunes que se
encuentran en los compuestos
orgánicos son
C, H, O, N, S, y X (halógenos).
b) La identificación de Ucarbono
e hidrógenoU
se logra si el compuesto
problema se hace reaccionar con óxido de cobre (CuO) a alta
temperatura para formar productos de oxidación característicos.
c) La identificación de Unitrógeno,
azufre y los halógenosU,
se basa
en la
conversión de ellos a sales solubles en agua y así poder
reaccionar con
reactivos específicos.
d) Uno de los métodos para
esta conversión es la Ufusión
alcalinaU
de los
compuestos orgánicos en presencia de sodio metálico.
UV. PROCEDIMIENTOU
1).- UIdentificación de carbono e hidrógeno por oxidación.U
En un tubo de ensayo limpio y seco provisto
de tapón con tubo
de desprendimiento, coloque una mezcla de U0.2
gU
de Umuestra
problemaU
y U0.4
gU
de Uóxido
cúpricoU
.
En otro tubo de ensayo coloque 5 ml
aproximadamente de solución
acuosa de hidróxido
de bario (nota 1).
Caliente entonces el primer tubo y reciba,
en el segundo tubo, el
gas que se
desprenda, haciéndolo burbujear dentro de la solución
de hidróxido de
bario.
Si hay presencia de UcarbonoU,
éste deberá desprenderse en forma de
dióxido de carbono
que al contacto con el hidróxido de bario
formará un
precipitado blanco de carbonato de bario. Si hay
presencia
de UhidrógenoU,
éste formará pequeñas gotas de agua que se
condensarán en la
parte superior de las paredes del tubo de ensayo.
REACCIONES:
[O]
![]() C +
CuO COB2B (gas)
C +
CuO COB2B (gas)
![]() COB2B +
Ba(OH)B2B BaCOB3B +
HB2BO
COB2B +
Ba(OH)B2B BaCOB3B +
HB2BO
(pp. blanco
insoluble)
Este precipitado se disuelve en medio ácido:
![]()
El UhidrógenoU
forma gotitas de agua:
[O]
![]() 4 H +
CuO P P2
HB2BO
4 H +
CuO P P2
HB2BO
U2).- Identificación de nitrógeno, azufre y
halógenos.U
MUétodo
de la fusión alcalina (Prueba de Lassaigne).U
En un tubo de ensayo limpio y seco, coloque U200
mg UdeU
sodioU
UmetálicoU
en trozos pequeños (nota 2). Con las pinzas lleve el
tubo a la flama
del mechero (Fisher) y caliéntelo moderadamente hasta
que funda el sodio
(se forma un glóbulo metálico). En ese momento
y fuera de la flama, agregue U100
mg Ude
laU
muestra problemaU.
Caliente el tubo de manera uniforme para
que todo el contenido se
carbonice
y manténgalo en la flama hasta que alcance el Urojo
vivo;U
continúe así durante 10 a 15 minutos.
Retírelo entonces de la flama y Udéjelo
enfriarU.
Agregue luego U1
ml Ude
etanol gota a gota y agitando con el fin
de disolver el
sodio que no reaccionó. Esta disolución origina
desprendimiento de
burbujas. Remueva el fondo del tubo con el
agitador y si es necesario agregue más etanol,
hasta U3
mlU.
Al terminar el burbujeo agregue U10
mlU,
aproximadamente, de UaguaU
UdestiladaU
y vuelva a calentar (ahora con el mechero Bunsen) a fin de
solubilizar completamente las sales de sodio formadas.
Filtre, por filtración rápida, el contenido
del tubo (primero humedezca
el filtro con agua
destilada); el filtrado deberá ser
transparente y
traslúcido y de pH
alcalino.
REACCION
![]()
U Con
el filtrado se harán las siguientes pruebas:
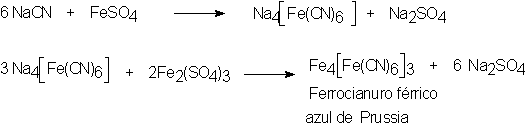
a) UIdentificación de nitrógeno:U
En un tubo de ensayo coloque 100 mg de
sulfato ferroso y agregue
1 ml del filtrado. Caliente con cuidado y
agitación continua
hasta ebullición
duante 1 ó 2 minutos, inmediatamente agregue
con precaución
gotas de ácido sulfúrico diluido (1:1) con el fin
de disolver los
hidróxidos, ferroso y férrico, que se hubieran
formado por la
oxidación con el aire durante la ebullición.
El pH deberá ser ácido.
Deje reposar el
tubo durante 5 ó 10 minutos. La aparición de
un UprecipitadoU
o coloración Uazul
de Prussia Uindica
la presencia de
nitrógeno.
REACCION:
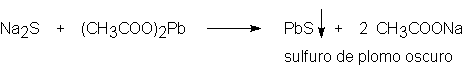
Ub).- Identificación de azufre.U
Pueden hacerse las dos pruebas siguientes:
bB1B) En un tubo de
ensayo coloque 1 ml del filtrado, acidule con
gotas de ácido
acético diluido (1:1) agregue gotas de solución
de Uacetato
de plomoU
y caliente. La aparición de un UprecipitadoU
UoscuroU
indica la presencia de azufre en forma de ion sulfuro.
REACCION:
bB2B) En un tubo de ensayo coloque 1 ml del
filtrado y agregue gotas
de solución de Unitroprusiato
de sodio.U
La aparición de una
coloración UpúrpuraU
indica la presencia de azufre en forma de
ion sulfuro.
REACCION:
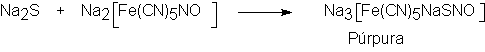
c).-
UIdentificación de
halógenos.U
En un tubo de ensayo coloque 1 ml del
filtrado, acidule con ácido nítrico diluido (1:1) y caliente hasta ebullición
para eliminar a los sulfuros en forma de ácido sulfhídrico y a los cianuros
como ácido cianhídrico (nota 3). Añada entonces gotas de solución de Unitrato de plata U
hasta la aparición de un precipitado de halogenuro(s) de plata.
Si la muestra contiene solamente UunoU de los halógenos, se podrán observar los
siguientes precipitados:
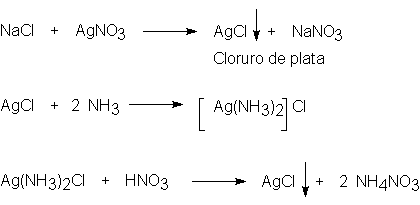
UCloruro.-U
El cloruro de plata es un Uprecipitado
blanco caseosoU
que por
acción de la
luz o el calor toma un color violeta oscuro. Este
precipitado Ues
solubleU
en hidróxido de amonio y vuelve a
precipitar si se agrega ácido nítrico.
REACCION:
UBromuro.-U
El bromuro de plata es un Uprecipitado
amarillo cremaU.
Es UparcialmenteU
soluble en hidróxido de amonio.
REACCION:

UYoduro.-U
El yoduro de plata es un Uprecipitado
amarilloU
que es UinsolubleU
en hidróxido de
amonio.
REACCION:
![]()
Yoduro de plata
d).-
UCloro, bromo,
yodo. Determinación conjunta.U
Si en el filtrado se encuentran Ulos
tres U
aniones, se procede de
la siguiente
manera para su identificación:
En un tubo de ensayo coloque 1 ml del
filtrado, acidule con
gotas de ácido
sulfúrico diluido (1:1), enfríe y añada 1 ml
de tetracloruro
de carbono. Añada lentamente una gota de agua
de cloro y agite
(nota 4).
Si el UyoduroU
está presente, éste se oxida rápidamente por el
agua de cloro y pasa a Uyodo
elementalU
que se deposita en el
tetracloruro, impartiéndole una coloración Uvioleta
rojizo oU
UpúrpuraU.
A medida que se sigue agregando agua de
cloro y agitando, el
color púrpura
desaparece, pues el yodo se oxida a yodato y si
el UbromuroU
está presente, éste a su vez se oxida aU
bromoU
e
imparte ahora una coloración Ucafé
rojizo o ámbarU
al tetracloruro
de carbono.
REACCION:
_ [ O ]
_ [ O ]
![]()
![]() I IB2B Br
BrB2B
I IB2B Br
BrB2B
agua de
cloro
agua de cloro
Finalmente, para identificar el UcloroU,
tome en un tubo de ensayo
1 ml del filtrado alcalino y acidúlelo
con gotas de ácido
acético, añada
300 mg aproximadamente de dióxido de plomo y
caliente a
ebullición para eliminar el bromo y el yodo.
Agregue 4 ml de agua destilada y filtre
el residuo de dióxido de
plomo.
En el filtrado se hace la Uprueba
para cloruroU
con Unitrato
deU
UplataU,
en medio nítrico diluido (gotas).
NOTAS
1) Prepare la solución mezclando 300 mg de
hidróxido de bario
con 8 ó 10 ml
de agua destilada. También se pueden emplear
hidróxido de
calcio.
2) Extreme
los cuidados al trabajar con sodio. Use las gafas de
protección,
use las pinzas para tubo, evite el contacto del
sodio con la
piel ya que puede ocasionarle quemaduras. No lo
ponga en
contacto con el agua, pues reacciona violentamente.
3) Verifique
la eliminación de sulfuros, colocando en la boca
del tubo un
papel filtro humedecido con gotas de solución
de acetato de
plomo. La eliminación ha sido completa cuando
el papel
filtro no se oscurece por la formación de PbS.
4) Para
preparar el Uagua
de cloroU
se puede seguir cualquiera de los dos procedimientos siguientes:
a).- Mezcle 5 ml de
solución de hipoclorito de sodio comercial
y 2 ml de ácido
clorhídrico concentrado (en la campana).
El gas cloro se desprende en
forma de pequeñas burbujas.
b).-Pese 0.3 g de clorato de potasio
(KCl0B3B),
disuelva con 5 ml
de agua destilada
y agregue 5 ml de HCl concentrado, Upoco
a
U pocoU
yU
con agitación U(en
la campana).
UVI. ANTECEDENTESU.
a) Pruebas generales de identificación en
el análisis cualitativo
elemental
orgánico.
b) Pruebas
de identificación de carbono e hidrógeno.
c) Método
de la fusión alcalina. Identificación de nitrógeno,
azufre, cloro,
bromo, yodo.
d) Reacciones
que se efectúan en cada caso.
e) Interferencias
más comunes en estas pruebas de identificación.
f) Otros
métodos de análisis elemental.
UVII. CUESTIONARIO
a) ¿Cuál es el
principio en el que se basa el análisis cualitativo
elemental orgánico
por el método de fusión alcalina?.
b) ¿Cuál es el principio en el que basa la determinación cualitativa
de carbono e
hidrógeno en estas pruebas de laboratorio?.
c) ¿Cuál es el principio en el que se basa el análisis conjunto
de yodo y
bromo en presencia de agua de cloro y tetracloruro
de carbono?.
d) Mencione
5 propiedades y/o características de las sustancias,
que
contribuyan a su identificación cualitativa elemental.
e) ¿Qué
otro tipo de análisis podría realizarse para confirmar
la
información obtenida en estas pruebas de laboratorio?.
f) ¿Cuál es la forma correcta de eliminar desechos de ácido
sulfúrico,
ácido nitrico y ácido acético?.
g).¿Cómo se eliminan desechos de sales inorgánicas? Como por
ejemplo
carbonato de bario, cloruro de bario, ferrocianuro férrico,
sulfuro
de plomo o haluros de plata.
UVIII. BIBLIOGRAFIAU
a) Vogel A.I.
A Textbook of Practical Organic Chemistry
Third
Edition
Longmans
b) Shriner R.L., Fuson, R.C.. y
Curtin D.Y.
Identificación Sistemática de Compuestos Orgánicos
Limusa
México, 1977.
c)
Brewster R.Q., Vander Werf C.A. y Mc Ewen W.E.
Curso Práctico de Química Orgánica
2PaP.
Edición
Madrid, 1979.
d)
Pavia D.L., Lampman, G.M. and Kriz G.S.
Introduction to
Organic Laboratory Techniques
W.B. Saunders Co. Piladelphia, 1976.